软组织肉瘤
软组织肉瘤是一类间叶来源的恶性肿瘤,可发生于全身各个部位,各年龄段均可发病、种类繁多且生物学行为各异。
别名:
软组织肿瘤
soft-tissue sarcoma
软组织性肉瘤
英文名:
Soft tissue sarcoma
发病部位:
软组织
就诊科室:
肿瘤科
症状:
无痛性肿块
多发人群:
所有人群
治疗手段:
综合治疗
是否遗传:
不确定
是否传染:
否
疾病知识
症状
较常见的临床表现为无痛性肿块,受累神经压迫症状,受累关节活动受限,局部破溃感染、畸形及皮肤温度升高,胸腹水,区域淋巴结肿大等。不同部位的软组织肉瘤肿物大小不同——发生于四肢近端及腹膜后的肿物较大,发生于四肢远端的肿物较小。软组织肉瘤病程短,较早出现血行转移,肺转移最常见,其次为局部术后复发,原发于腹部的肉瘤较易发生肝转移、腹膜转移及局部复发。
病因
软组织肉瘤病因目前尚不明确。可能与内环境因素和外环境因素有关
检查
1. X线检查
由于软组织肉瘤易发生远处转移且80%发生于肺、纵隔,应常规进行胸部影像学检查。X线摄片还可以显示肿瘤周围骨质破坏情况及骨膜反应,如出现骨破坏,常提示为高度恶性肉瘤。钙化点只表示肿瘤曾有出血及坏死,无诊断特异性。肿瘤呈透亮区,则提示有脂肪源性肿瘤可能。
2、计算机断层扫描(CT)
CT诊断软组织肉瘤,其特点为无损伤性及分层肿瘤显像,同时可探明肿瘤与邻近骨、肌肉结构。术前肺部CT检查可检出早期肺部转移癌。腹膜后肉瘤CT检查,可以明确肿瘤与重要脏器的毗邻及侵袭关系。对于不能进行MRI检查者可采用CT血管成像,有助于术前肿瘤的评估及手术计划的制定。
3、核磁共振扫描(MRI)
与CT比较,MRI更能从多角度描述肿瘤与邻近组织的异同。对各种软组织内部结构的分辩率明显优于CT,更适合软组织肉瘤的检查,尤其对于肢体软组织肉瘤的检查,效果明显优于CT。但是,MRI不能用于判定肿瘤的良恶性。
4、超声显示肿块为实质或不均质性并伴有丰富血运者常提示软组织肉瘤可能大,常常用于软组织肿瘤的初筛检查。临床应用超声检查诊断了解肿瘤大小,边界及与其血管的关系。超声波检查还是术后随访的重要手段,可及早发现病灶复发。
5、动脉造影
应用动脉造影可了解肿瘤内血管的分布情况,恶性肿瘤富于血管,分布紊乱,良性肿瘤血管较少。动脉造影对于毗邻重要血管的肿瘤评估保肢手术适应症有较大作用。良性血管瘤由于血管丰富,不易于恶性肿瘤鉴别。
6、同位素扫描(ECT)
对于高度恶性的软组织肉瘤,ECT检查有利于筛查骨转移瘤的存在,以利于早期诊断及系统治疗。还可以明确高度恶性软组织肉瘤对肿瘤周围骨质破坏情况,如出现异常核素浓聚,常提示肿瘤可能侵犯临近骨质,对于明确手术切除范围及术式有指导意义。
7、正电子发射断层显像扫描(PET-CT)
PET-CT获得的肿瘤代谢数据用于指导预后、分期和评价化疗反应,对评价肿瘤的分级及指导预后很有帮助。PET-CT在高度恶性软组织肉瘤的术前化疗评效方面具有明显优势,并且可能预测肿瘤的治疗效果及预后。
诊断
1、肿块的部位、大小、质地、活动度、生长速度和区域淋巴结等初步判断其良、恶性及其可能的组织来源。良性肿瘤呈膨胀性生长,基本上不侵犯其周围的骨、血管和神经组织,触诊大多活动度较好,质地相对也较为柔软,其生长较为缓慢,往往不伴有疼痛和酸胀等局部症状。一旦发现肿块生长加速或伴有临床症状时,要及时就诊进行活检,明确病理诊断。常见软组织肉瘤中,胚胎型横纹肌肉瘤生长速度最快,其次是未分化多形性肉瘤,分化较好的黏液脂肪肉瘤生长缓慢。透明细胞肉瘤、滑膜肉瘤、上皮样肉瘤、血管肉瘤、胚胎型横纹肌肉瘤和未分化肉瘤等易发生淋巴结转移。
2、X线平片检查:对软组织肉瘤的定性和定位诊断敏感性和特异性都不高,只有在肿瘤内有较多的钙化、骨化或以成熟的脂肪组织为主的病变中,X线有特征性表现,才显示出一定的诊断价值。另外,X线平片可以清楚地显示肿瘤邻近骨骼的改变,可帮助显示软组织肿块与邻近骨与关节的关系。
3、超声检查:
超声检查的优势在于:
(1)鉴别浅表软组织肿块性质:特别是对于神经源性肿瘤、脂肪瘤、血管瘤、各种囊肿和动静脉畸形有较高的诊断价值;
(2)区域淋巴结检查:主要用于手术前、后检查易于发生淋巴结转移的软组织肉瘤;
(3)腹盆腔和腹膜后检查:用于了解该部位软组织肉瘤的范围及其与周围组织的关系,发现肿瘤肝脏等腹盆腔器官转移;
(4)超声引导下穿刺活检:操作时间短,准确性与CT引导相当。
4、CT检查:
CT具有理想的定位效果和较好的定性诊断能力,增强扫描可以明确显示肿块的大小、边界及其与周边各相邻组织的关系。对于细小钙化、骨化及骨质破坏的显示优于磁共振成像(magnetic resonance imaging, MRI);对于腹盆腔和腹膜后软组织肉瘤的检查,CT增强扫描也显示出更多的优越性,但其对软组织的分辨力仍不及MRI;对于早期发现软组织肉瘤肺转移和胸腔积液,胸部CT检查可作为首选。四肢黏液样脂肪肉瘤的患者容易出现腹腔转移,需要常规进行腹部CT检查。腺泡状软组织肉瘤、透明细胞肉瘤和血管肉瘤患者容易出现头面部转移,需要常规进行头颅CT检查。在诊断和鉴别诊断困难时,根据治疗的需要可以采用CT引导下穿刺活检,具有损伤少、费用低和准确性高的特点。
5、MRI检查:MRI具有较CT更好的软组织分辨率,又具备多平面扫描、多序列检查的特点,可以从各种不同的角度和方向准确显示病变的部位及其与周围结构的关系,还可以通过增强扫描或磁共振血管造影检查以明确病变血供及其与邻近血管神经干的关系。软组织肉瘤内某些特殊成分在MRI序列中有特定的信号特征,可以通过选择MR的不同回波序列帮助确定病变的病理性质,正确区分软组织肿块、手术后改变或术后复发等。MRI是目前四肢和躯干、脊柱等部位软组织肉瘤诊断与鉴别诊断、分期、手术治疗方案制订、术后随访的首选影像检查方法。软组织肉瘤于MRI引导下穿刺活检定位更准确,可以避免穿刺到坏死、囊变和出血部位,提高活检成功率,但费用相对较高。
6、核医学检查:
(1)发射型计算机断层成像术:全身骨骼放射性核素显像是早期发现软组织肉瘤骨转移的首选方法,由于假阳性率较高,其不能作为诊断依据,可进行疾病分期、预后判断和疗效观察等。对于发现可能出现病理性骨折的危险部位、肿瘤与骨骼的相互关系等帮助不大。
(2)正电子发射计算机断层扫描(positron emission tomography/computed tomography, PET-CT):不同组织来源和不同性质的软组织肉瘤对18F-脱氧葡萄糖(18F-FDG)的摄取有一定的差异,目前无法单纯通过最大标准化摄取值确定肿瘤的组织来源、良恶性和恶性程度分级。由于PET-CT显示软组织肉瘤的大小、范围及其与周边组织的关系等局部细节不如CT和MRI,因此,不作为手术前常规的检查手段,目前主要用于判断软组织肉瘤的手术后残留、复发和远处转移,对于转移性软组织肉瘤可以帮助寻找原发病灶。
7、病理与细胞学检查:
(1)软组织肉瘤的病理标本处理和大体标本检查至少应包括以下内容:
①标本拍照:分别拍摄新鲜状态下和固定后的大体形态,包括切面情况。
②标本固定:有组织库的单位,在标本固定前取小块新鲜肿瘤组织,液氮或超低温冷冻保存,以备分子检测所需。标本应在离体30 min内充分固定,标本固定前需用染料标识各切缘,体积大的肿瘤需分层剖开后再固定。固定液采用中性福尔马林,固定时间不超过48 h。
③标本取材:包括肿瘤和各切缘组织。具体的取材数量视具体情况而定,体积较小者全部取材,体积较大者尽可能多取肿瘤组织,并包括坏死灶和肉眼可见的正常组织等不同区域。
(2)完整的软组织肉瘤病理报告包含内容参见文献。
(3)软组织肉瘤穿刺活检标本的处理和要求:
①细针穿刺活检标本:细针穿刺活检获得的是细胞,缺乏组织的完整性,病理诊断的局限性较大,难以做出准确诊断,仅能用于与上皮组织的鉴别,足够量的标本有可能确定肿瘤的性质,但是分型较为困难。因此,无法替代软组织肉瘤的组织病理学诊断。
②空芯针穿刺活检标本:空芯针穿刺活检是目前最常用的活检手段,定性诊断较细针穿刺活检容易,但毕竟标本量有限,明确病理分型有其局限性,最终有待术后病理诊断证实。
③软组织肉瘤的术中冰冻诊断:原则上不主张进行术中冷冻切片诊断,对一些可能需要采取重大手术(如截肢或半骨盆切除等)的病例,应尽可能在术前明确病理诊断。
(4)病理科医师对手术标本的基本要求:
①将标本送至病理科前做好标本各切缘的定位标记工作,便于病理医师准确报告各切缘情况。
②有组织库的单位应由专职人员在不毁损标本的情况下留取少量新鲜的肿瘤组织。
③有条件进行标本预处理的单位应将术后离体标本迅速送至病理科,或者在30 min内用中性福尔马林固定标本,对体积较大的肿瘤应分层剖开完全浸泡于固定液内,以使标本得到充分固定。
治疗
目前软组织肉瘤的诊治仍强调遵循多学科综合诊治原则,需要多学科综合诊治的主要是诊断疑难复杂或在治疗上各学科存在争议的软组织肉瘤患者,组织骨与软组织肉瘤外科、肿瘤内科、放疗科、影像科、病理科和介入治疗科等相关科室的专家进行讨论。根据患者的年龄、身体基本状况、病理类型和肿瘤侵犯范围等,认真阅片分析病情,依据最有利于患者疾病治疗和改善预后的原则,制订出有计划、按步骤地逐步实施的整体治疗方案,尽量让患者在治疗计划中获得最大的收益。但是对于已经获得R0切除、病理级别较低的Ⅰ级或部分Ⅱ级软组织肉瘤,术后予以定期随访或局部辅助放射治疗即可,无需所有病例均一成不变、刻板地进行多学科讨论。软组织肉瘤的多学科综合诊治流程见图1。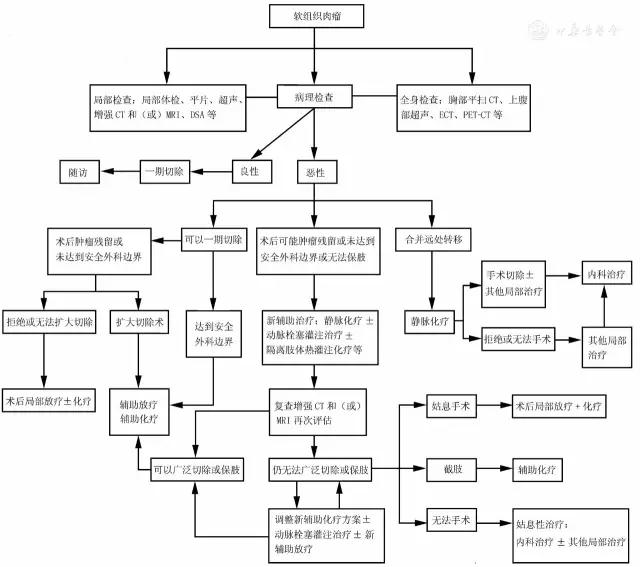
一、外科治疗
(一) 正确的外科手术是治疗软组织肉瘤最有效的方法,也是绝大多数软组织肉瘤唯一的治愈措施。手术的目标不仅是完整切除肿瘤,而且要求获取安全的外科边缘。术后功能恢复与安全边界发生矛盾时,通常以牺牲部分功能为代价。
通常,安全外科边界是指MRI显示软组织肉瘤边缘或反应区外1 cm处,手术是在保证安全外科边界基础上追求完整切除肿瘤。对于体积较大、较深或侵犯邻近大血管、神经、关节和骨骼等重要组织的肿瘤,预计一期手术难以达到根治切除,而对化放疗相对敏感的肿瘤,需要术前放化疗和介入治疗等手段使肿瘤体积缩小、坏死和形成明显的假包膜,从而为手术获得安全外科边界创造条件。
不规范的手术操作往往会导致:
(1)非计划再次手术,即软组织肉瘤患者在第1次手术时,因各种原因导致肿瘤残留(R1~R2切除)或切缘未达到安全外科边界,需接受计划外再次手术;
(2)人为破坏肿瘤包膜不能完整切除肿瘤;(3)活检穿刺道不包括在手术切除的范围内;(4)手术中反复挤压肿瘤组织等影响外科手术治疗的成功率。
规范的手术操作建议:
(1)术前基于病理和MRI等资料制订手术方案,设计最佳瘤体取出路径和重建所需的技术准备;
(2)将活检道与肿瘤作为一个整体同时切除;
(3)直视下必须努力获得安全边界,必要时可以同期进行2个方向的显露,如躯干和骨盆的软组织肉瘤;
(4)误入肿瘤时无论是否达到肿瘤实质,均应立即严密缝合并扩大切除;
(5)贴肿瘤面切除时需要特别标记,并在术后获取切缘信息;
(6)切除的标本必须标记极相,并要求病理医师出具边缘是否残留的评价报告;
(7)肢体位置较深的高级别软组织肉瘤,尽量实施间室切除或间隙切除。软组织肉瘤手术不推荐常规清扫区域淋巴结,对于容易发生淋巴结转移的透明细胞肉瘤、上皮样肉瘤、血管肉瘤、胚胎型横纹肌肉瘤和未分化肉瘤等,应常规检查淋巴结。如影像学检查怀疑有淋巴结转移,应在切除原发肿瘤的同时行淋巴结清扫术,术后病理若证实区域淋巴结转移且侵及包膜外者,需要术后放疗。软组织肉瘤的综合治疗流程见图2。
(二)四肢软组织肉瘤的外科治疗
1.诊断推荐:
四肢软组织肉瘤术前应尽量明确病理诊断,通过影像学检查了解肿瘤与周边组织的关系后再制订相应的手术方案。
(1)首选的影像学检查为MRI,活检或术前需要进行增强扫描,必要时选择弥散成像、脂肪抑制等功能,以便进一步鉴别肿瘤的类型。如MRI无法清晰显示病灶与周围组织的相互关系,推荐行增强CT作为补充。
(2)活检主要采取空芯针穿刺和切开活检2种方式。空芯针穿刺活检明确诊断后,可对手术者制订完整的手术方案提供帮助。切开活检创伤较大,只用于空芯针穿刺活检无法明确诊断的患者。术中冰冻切片病理诊断的准确率与病理学家诊断软组织肉瘤的水平密切相关,仅推荐有条件的医院开展。切除活检仅用于初步诊断为良性肿瘤,且可以一次完整切除的患者。
2.外科治疗:
严格按照肿瘤外科的原则进行R0切除依然是治疗四肢软组织肉瘤的主要手段,广泛切除可明显降低局部肿瘤的复发率和死亡率,一旦无法达到R0切除,需要进行术前放化疗和介入治疗,否则有必要进行截肢。
术前诊断为化疗敏感型肿瘤,如尤文肉瘤/原始神经外胚层肿瘤、胚胎型横纹肌肉瘤和其他小圆细胞恶性肿瘤,实施术前全身化疗不仅可有效地降低肿瘤负荷、提高R0切除的比例、防止出现早期肿瘤远处转移,而且可以根据肿瘤坏死率选择术后化疗方案。
3.手术方式:
四肢软组织肉瘤手术治疗的标准方式有以下几种:
(1)间室切除;
(2)广泛切除;
(3)截肢。积极推荐间室切除和广泛切除,可能保留肢体的全部或部分功能。如果肿瘤侵犯多个间室或主要血管、神经,不能达到间室切除或广泛切除,保肢手术不可能获得满意的外科边界,截肢手术将使患者获益。截肢的适应证:
(1)重要血管、神经束受累;
(2)缺乏保肢后骨或软组织重建条件;
(3)预计假肢功能优于保肢;
(4)患者要求截肢。区域或远处转移不是截肢手术的禁忌证。
4.局部复发的外科治疗:
局部复发的软组织肉瘤,无论是否合并远处转移,局部复发灶均可以考虑手术切除,基本要求是将复发肿瘤和皮肤切口在内的瘢痕组织一并切除。切除方式:
(1)根治性切除:在解剖结构允许的情况下完整间室切除或关节离断;
(2)扩大广泛切除:切除复发肿瘤和瘢痕组织,及其周边>5 cm正常组织;
(3)边缘切除:切缘通过复发肿瘤瘢痕的切除;
(4)广泛切除:切缘通过正常组织,但切除范围未达到扩大广泛切除术的要求。
一期完整切除困难者,仍然可以选择术前化、放疗和介入等治疗手段。低级别肉瘤未出现远处转移可以仅仅手术切除,原则上无需术后全身化疗。高级别肉瘤需要在全身治疗的基础上,待复发病灶稳定后再进行手术切除,术后辅助化、放疗。
5.远处转移的外科治疗:
软组织肉瘤最常见的远处转移器官是肺,是否能够完整切除转移病灶对患者的生存期至关重要。孤立病灶一次性手术切除,可切除的多发转移者建议经化疗病情稳定后再接受手术治疗。对于化、放疗较敏感的多部位转移灶经化、放疗病情控制后,姑息性切除影响患者生活质量的病灶,也已经被学界广泛接受。
(三)躯干软组织肉瘤的外科治疗
硬纤维瘤(纤维瘤病)、脂肪肉瘤和肌原性肉瘤是最常见的胸壁肉瘤。脊柱是骨转移癌和多发性骨髓瘤的好发部位,发病率是原发骨肿瘤的30倍以上,其次是原发性骨肿瘤,软组织来源的肿瘤相对较少,主要是发生于神经末梢的脊索瘤和神经鞘瘤、血管肉瘤以及来源于椎旁软组织的未分化多形性肉瘤、滑膜肉瘤、脂肪肉瘤等。胸部软组织肉瘤多以无痛性肿块作为首发症状就诊,脊柱旁软组织肉瘤早期可能侵及脊髓或神经根,可能出现相应部位疼痛和运动和(或)感觉神经功能障碍。
躯干和脊柱软组织肉瘤R0切除率明显低于四肢,其局部控制率和预后远不如四肢。脊柱及其椎旁软组织肉瘤邻近脊髓、神经根及其周边的重要血管,手术中难有清晰的肿瘤边界,且需考虑保留脊髓、神经功能,即使En-bloc手术有时也很难达到R0切除。术前病理诊断为化、放疗敏感肿瘤者推荐术前化、放疗后再择期手术。术中注意保护脊髓、神经和重要血管,术后再进行化、放疗可以提高局部控制率。对于肿瘤无法彻底切除者推荐先行减瘤手术,缓解肿瘤对脊髓及神经的压迫,改善症状,提高患者生活质量。
(四)腹、盆腔软组织肉瘤的外科治疗
腹、盆腔软组织肉瘤包括腹膜后、盆腔侧壁以及腹、盆腔脏器来源的软组织肉瘤,占所有软组织肉瘤的10%~15%,多见于50岁左右的患者。腹膜后和盆壁来源的软组织肉瘤主要的病理亚型是脂肪肉瘤、平滑肌肉瘤、未分化多形性肉瘤、孤立性纤维瘤和神经鞘膜瘤,脏器来源的软组织肉瘤最常见的是子宫平滑肌肉瘤。该部位的肉瘤预后较肢体和躯干软组织肉瘤差,手术完整切除和病理分级是影响预后的主要因素。
手术仍是腹、盆腔软组织肉瘤获得根治的唯一可能手段,一期完整切除肿瘤是决定患者长期生存的最重要预后因素。因该部位解剖结构复杂,肿瘤常累及相邻的器官和重要的血管、神经等结构,术前需有充分的预估,常需要多学科团队协作共同完成手术。
1.首次手术是患者获得可能根治的最佳时机,最佳的手术方式和切缘需要根据肿瘤的病理级别和分期而定:
低级别肉瘤应尽可能做到广泛切除,高级别肉瘤需要手术联合放化疗等手段综合治疗,不推荐腹腔镜手术。
2.手术计划应以详尽的影像学和病理学诊断为基础:
应充分认识到不同类型肿瘤不同的生物学行为和预后,一般不建议根据术中冰冻切片的病理结果决定手术切除范围,也不建议进行探查性手术。冰冻病理仅在处理如血管平滑肌肉瘤或评估神经切缘等特殊情况下有辅助作用。对放化疗敏感的肿瘤提倡术前新辅助放化疗直至肿瘤明显缩小,力求获得完整切除。
3.肉眼残留或镜下切缘阳性增加了局部复发的风险:
如肿瘤紧邻不能安全切除的结构或器官,术后放疗可以提高肿瘤的局控率,并延长无复发生存期。姑息减瘤术仅对某些低级别的肉瘤是一种合理的治疗选择,对于高级别肉瘤患者虽然可以暂时缓解部分临床症状,但不能改善总生存时间,手术并发症和死亡率都很高,需要对手术利弊进行权衡。
4.可切除的局部复发病灶,应努力争取获得再次完整切除:
对于组织学分级高、进展迅速、无复发间期短和多灶性的肿瘤,应谨慎选择再次手术的患者。部分经过选择的患者可能从放疗、化疗、局部热疗中获益。
5.经影像学检查发现以下情况时应判断为肿瘤不可完整切除:
(1)广泛的大血管动脉、腔静脉和(或)髂血管侵犯(腔静脉和髂血管受累是手术的相对禁忌证);
(2)广泛的腹膜种植;
(3)多部位远处转移;
(4)肠系膜根部主要大血管侵犯;
(5)椎体和(或)脊髓侵犯。
二、放射治疗
局部广泛切除+辅助放疗目前是可手术切除、病理高级别软组织肉瘤的标准治疗模式,放疗的疗效取决于软组织肉瘤的病理类型和肿瘤负荷量。通常,病理高级别软组织肉瘤,如尤文肉瘤和横纹肌肉瘤等对放疗的敏感性较高,肿瘤负荷量愈小放疗效果愈好。不同病理类型软组织肉瘤的放疗时机、放射野设计和射线种类与能量、照射剂量和分割方式等的选择仍有待进一步达成统一意见。
(一)主要方式
1.单纯放疗:
单纯放疗是软组织肉瘤治疗最常应用的放疗方式,放疗剂量和照射野视不同大小、部位和病理类型的软组织肉瘤而定,常规剂量为50~75 Gy,分25~38次完成。
2.同步放化疗:
主要针对身体状况良好、无严重脏器疾患的中青年患者,局部控制率高于单纯放疗,尤其适用于恶性程度高和肿瘤体积较大的软组织肉瘤患者。同步放化疗中采用的化疗增敏药物主要有阿霉素、异环磷酰胺和顺铂等。视患者情况,可以使用单药或联合用药,如AI方案(阿霉素+异环磷酰胺)、AD方案(阿霉素+达卡巴嗪)或MAID方案(美司钠+阿霉素+异环磷酰胺+达卡巴嗪)等同步放化疗。
3.序贯放化疗:
序贯放化疗是指在放疗前、后使用化疗,其局部肿瘤控制率不及同步放化疗,但优于单纯化疗或放疗,血液学和胃肠道等不良反应相对同步放化疗较轻,适用于无法耐受同步放化疗的患者。
4.立体定向放射治疗(stereotactic body radiation therapy, SBRT):
主要包括γ刀、X刀、射波刀、TOMO刀以及属于高LET射线的质子和重粒子照射。目前SBRT用于脊髓侵犯、神经根受压等治疗效果优于普通直线加速器治疗,治疗进展缓慢的孤立性远处转移灶的软组织肉瘤有较好的近期疗效。
(二)主要类型
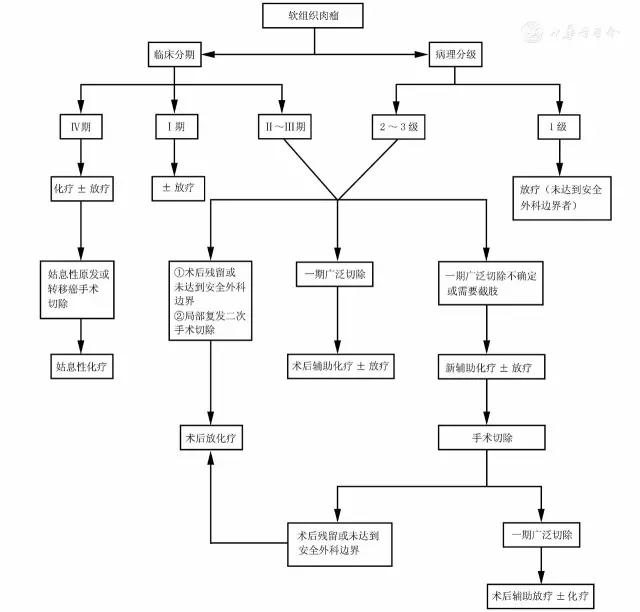
1.术后辅助放疗(1类推荐):
可以杀灭手术后残存的肿瘤细胞,减少局部复发甚至远处转移的机会。主要适应证:
(1)病理高级别肿瘤;
(2)肿瘤最大径>5 cm;
(3)手术切缘阳性或未达到安全外科边界,肿瘤侵犯周围血管、神经;
(4)肿瘤位置表浅、体积小、病理低级别、手术已达到安全外科边界者,术后辅助放疗不作推荐。
2.术前放疗(2A类推荐):
对于肿瘤较大、较深,与血管神经关系密切,局部切除困难或预期无法达到安全外科边界者,术前放疗联合或序贯化疗、介入治疗等可能缩小肿瘤体积,提高R0切除或保肢治疗的概率。
3.姑息性放疗:
主要适应证:
(1)对于经术前抗肿瘤治疗仍无法手术切除或手术可能严重影响肢体功能、无法保肢或拒绝截肢的局部晚期软组织肉瘤患者;
(2)针对局部晚期无法手术切除肿瘤导致的各种并发症,如疼痛、急性脊髓压迫症和肢体功能障碍等。主要目的:
(1)较长时间控制局部肿瘤生长;
(2)尽量延缓或减轻局部严重症状,提高生活质量;
(3)联合或序贯化疗、介入等其他治疗方法,达到延长患者总生存时间的目的。
三、内科治疗
(一)内科治疗的地位与作用
病理高级别的软组织肉瘤患者,初诊时10%已发生了转移,即使肿瘤局部控制良好,术后仍有40%~50%的患者会出现局部复发,>50%的患者会发生远处转移。因此,软组织肉瘤特别是高级别软组织肉瘤,需要多学科综合治疗已成为共识。内科治疗作为全身治疗手段,化疗有助于提高肿瘤R0切除率、增加保肢机会,还可以降低术后复发转移风险,对于复发转移的晚期患者可延长患者的总生存期和提高生活质量。
(二)化学治疗
化疗仍是当今软组织肉瘤最重要的内科治疗手段,分为新辅助化疗、辅助化疗和姑息性化疗等。
1.新辅助化疗:
对一期切除困难或不能获得R0切除,且对化疗敏感的成人高级别软组织肉瘤,可以使用新辅助化疗。具体适应证:
①化疗相对敏感的高级别软组织肉瘤;
②肿瘤体积较大,与周围重要血管神经关系密切,预计无法一期R0切除或保肢治疗;
③局部复发需要二次切除或远处转移行姑息手术前。术前化疗推荐方案:阿霉素(ADM)±异环磷酰胺(IFO)方案或MAID方案(美司钠+阿霉素+异环磷酰胺+达卡巴嗪)。
隔离肢体热灌注化疗不仅能使肿瘤局部获得更高的药物浓度,还可以利用局部热效应(38℃~39℃)进一步杀灭肿瘤细胞,提高肿瘤广泛切除率、增加保肢治疗的机会,能否带来生存获益目前尚无法最终定论。隔离肢体热灌注化疗可与术前静脉化疗、放疗等治疗手段同步或序贯进行,因联合治疗不良反应较重,推荐功能状态(performance status, PS)评分0~1分、病理分级为2~3级且肿瘤体积巨大、肿瘤与重要血管神经关系密切预期常规新辅助化疗后仍难以获得R0切除或需要保肢的患者采用。
2.辅助化疗:
对于Ⅰ期有安全外科边界的软组织肉瘤患者,不推荐辅助化疗;对于Ⅱ~Ⅲ期患者,建议术后放疗±辅助化疗,对有以下情况的Ⅱ~Ⅲ期患者强烈推荐术后辅助化疗(2A类推荐):
(1)化疗相对敏感;
(2)高级别、深部、直径>5 cm;
(3)手术未达到安全外科边界或局部复发二次切除后的患者。横纹肌肉瘤建议术后辅助化疗12个周期,骨外骨肉瘤12~15个周期,骨外尤文肉瘤16~18个周期。除此以外的其他软组织肉瘤的辅助化疗一致推荐ADM±IFO方案,建议化疗6个周期。
3.姑息性化疗:
对于不可切除的局部晚期或转移性软组织肉瘤,积极有效的化学治疗有利于减轻症状、延长生存期和提高生活质量。对于多次多线化疗失败,已经证明很难从化疗中获益,且美国东部肿瘤协作组体能状态(Eastern Cooperative Oncology Group Performance Status, ECOG-PS )评分>1分的患者,不推荐再次化疗。
(三)化疗药物及方案
1.一线化疗药物及方案:
ADM和IFO是软组织肉瘤化疗的两大基石,一线化疗方案推荐ADM单药75 mg/m2,每3周为1个周期,不推荐增加ADM的剂量密度或序贯除IFO以外的其他药物。
表阿霉素(EPI)和聚乙二醇脂质体阿霉素(PLD)的不良反应,尤其是心脏毒性和血液学毒均小于ADM,但治疗软组织肉瘤的疗效并不优于ADM。因此,对于患心脏基础疾病不适合使用ADM以及ADM已接近最大累积剂量的晚期软组织肉瘤患者,一线使用EPI和PLD的依据不足,有ADM化疗失败者使用PLD获益的报告。
与ADM相比,IFO无疗效和不良反应优势。对于无法耐受或拒绝蒽环类药物的患者,一线化疗可推荐IFO单药8~10 mg/m2,每3周为1个周期,不推荐大剂量IFO(12~14 g/m2)或持续静脉滴注作为辅助治疗。
与ADM单药化疗相比,ADM+IFO方案以及其他含ADM的联合化疗方案尽管可以提高有效率和无进展生存时间,但也增加了不良反应,并未显示出总生存优势。因此,不常规推荐作为一线辅助化疗。对于希望通过化疗尽快缩小肿瘤、缓解症状或因此而获取手术切除机会的<60岁、ECOG-PS评分为0~1分的患者可作为一线推荐,但需要注意药物剂量和及时防治不良反应。
2.二线化疗药物及方案:
一线化疗失败的软组织肉瘤目前尚无公认的二线化疗药物及其方案。对于一线化疗已使用过ADM+IFO方案且PFS≥1年者,可以考虑再次使用原方案治疗,以下均为1类推荐:
(1)一线化疗未用ADM和IFO:ADM±IFO方案。
(2)一线化疗已用ADM或IFO:ADM和IFO两药可以互为二线。
(3)一线化疗已用ADM和IFO:ADM或IFO单药高剂量持续静脉滴注。使用ADM±IFO方案辅助化疗后不足1年复发或转移者,可选用以下药物单药或联合化疗(2A类推荐):
(1)吉西他滨(GEM):平滑肌肉瘤和血管肉瘤的二线化疗药物。
(2)达卡巴嗪(DTIC):平滑肌肉瘤和孤立性纤维瘤的二线化疗药物。
(3)曲贝替定(ET-743):欧洲药品管理局批准曲贝替定1.5 mg/m2,每3周为1个周期,用于治疗蒽环类药物和IFO治疗失败,或不适合这些药物治疗的晚期软组织肉瘤患者,主要用于治疗平滑肌肉瘤和脂肪肉瘤,尤其是黏液样/圆细胞型脂肪肉瘤。
(4)艾瑞布林(E7389):艾瑞布林1.4 mg/m2,第1、8天,每3周为1个周期。平滑肌肉瘤和脂肪肉瘤的二线化疗药物。
(5)联合化疗:GEM+多西他赛可作为平滑肌肉瘤和未分化多形性肉瘤的二线首选化疗方案,GEM+DTIC、GEM+长春瑞滨作为二线联合化疗方案,较单药有生存优势。
四、软组织肉瘤复发转移的治疗: 复发转移的软组织肉瘤患者首先需要全面评估患者一般状况,明确复发和转移灶的部位、大小、数量以及与邻近重要组织器官的关系,明确治疗目的后,再制订个体化治疗方案。
(1)对于有可能获得第二次完全缓解(CR2)的病例,应在系统化疗等全身治疗基础上积极采取手术等局部治疗。化疗敏感或既往化疗获益的肿瘤,可以先全身化疗或局部动脉灌注化疗等,待病灶缩小、病情稳定后再行手术。对血管神经侵犯无法保肢的患者,可以考虑截肢手术。
(2)多发性转移、已经无法治愈的患者以延长生存期、提高生活质量为治疗目的。对于预期能够从化疗中获益的患者,可以使用二线化疗,以延缓疾病进展。对于有可能导致截瘫、病理骨折、肢体受压导致血栓形成、严重疼痛的病灶应积极开展姑息性手术、放疗和射频消融等局部治疗,提高患者的生活质量。
(3)对于病理低级别、生长缓慢、化疗不敏感或既往化疗未能获益且全身广泛转移的患者,不推荐三线及以上的药物化疗。
临床实践中首先推荐使用在中国大陆获得软组织肉瘤适应证并上市的药物;其次是使用已在国外获得适应证并上市,但在中国大陆未上市的药物;再次是使用在国内外均未获得适应证,但获得相关国家临床指南和专家共识推荐的药物;最后才是参考临床研究文献的报道结合多学科协作模式讨论结果和临床医师的个人治疗经验使用药物。治疗前需要与患者及家属详细交代上述情况以获得理解,并签字同意。积极推荐所有复发和转移患者参加国内外新药临床试验。
预后
软组织肉瘤总的5年生存率约60%~80%,影响预后的主要因素包括年龄、肿瘤大小、组织学分级、病理类型以及肿瘤发生部位及深度。一般来说,年龄大于60岁、肿瘤>125px,组织学分级为高级别的软组织肉瘤预后较差。
预防
本病没有特殊的预防方法,早发现、早诊断、早治疗。
健康问答
科普文章
参考资料
徐海荣 黄真 【病例分享】重组人血管内皮抑制素治疗骨及软组织肉瘤典型病例1例 2017-02-15 中国医学论坛报今日肿瘤.
词条标签
网友、医生言论仅代表其个人观点,不代表本站同意其说法,本站不承担由此引起的法律责任
微医提供平台支持 Copyright 2011-2017版权所有。 浙ICP备15034772号-2



