世界范围的脏器极度短缺已成为制约器官移植发展的主要问题,这一问题在肺移植更加突出。相对于其他器官,肺组织更易受损伤,在外伤等原因致死的供者中,常伴肺挫伤、误吸、感染、急性呼吸窘迫综合征等损害,脑死亡后还会继发神经源性肺水肿。因此,供肺利用率不高,仅为肾脏利用率的1/5。如何扩大供肺来源,提高供肺利用率,成为全球肺移植领域亟待解决的问题。近些年来,器官短缺的应对策略不断被提出:①完善器官捐献立法,进行公众捐献教育,使更多的民众在过世后愿意捐献;②应用边缘供体;③解决供受体大小不匹配的问题;④开展活体供肺肺叶移植;⑤开展血型不相容肺移植;⑥严格掌握单肺移植和双肺移植的指征,即一个供体的两个肺给两个单肺移植的患者;⑦区别于脑死亡供体(donationof brain death,DBD),心脏死亡器官捐献(donation after cardiac death,DCD)的术后移植物存活率已接近于有心跳供体器官,DCD再次引起世界移植界的广泛关注。
一、DCD供体肺移植
1.DCD应用的现实意义 在开展移植的早期,器官从无心跳的已死亡供体切取,也就是现在所说的无心跳捐献(DCD)。自从1968年脑死亡概念的建立,脑死亡后捐献(DBD)成为优先选择的器官来源。由于供体器官的持续短缺,DCD的供体器官重新引起重视,尤其是在诸如中国、日本等脑死亡的概念还没有被公众广泛接受的国家。
2. DCD供体分类 根据国际Maastricht分类标准,DCD分为5大类:M-I:入院前已经宣告死亡,但时间不超过45分钟。M-II:于医院外发生心脏停搏,急诊入院后经心肺复苏10分钟无效,宣告死亡。M-III:受到严重的不可救治性损伤,通常为毁灭性脑外伤,但还没有完全达到或完全满足脑死亡的全套医学标准;同时生前有意愿捐献器官,经家属主动要求或同意,在ICU中有计划地撤除生命支持和治疗,主要手段为终止呼吸机人工通气给氧,使心脏缺氧而停搏及残余脑细胞彻底失活,等待死亡的发生。M-IV:脑死亡判定成立后、器官捐献手术之前所发生的非计划性、非预见性心脏停搏。M-V:住院病人的心脏停搏(2003年新增标准)。主要为ICU中抢救过程中发生的非计划性、非预见性心脏停搏。上述五类又分为两大类,第1、2、5类统称为无准备型DCD,第3、4类统称为有准备型DCD。各分类供体的成功移植均见报道,然而,无准备型DCD是循环停止时间较长或心肺复苏失败的供体,其热缺血时间难以控制,这种器官在移植后常常质量不佳,术后PGD发生率高,易致早期死亡,因而较难普及;有准备型DCD,是指有条件在循环停止后迅速获取器官的供体,通常在手术室内送行,缺血时间相对较短,预后满意,且来源较广,尤其是第3类,是目前DCD的主要来源。
中国分类依据前期探索经验并参照国际分类,将我国现阶段公民逝世后心脏死亡器官捐献分为三大类:(1).中国一类(C-I):国际标准化脑死亡器官捐献(DBD),即:脑死亡案例,经过严格医学检查后,各项指标符合脑死亡国际现行标准和国内最新脑死亡标准(中国脑血管病杂志,2009年6卷4期),由通过卫生部委托机构培训认证的脑死亡专家明确判定为脑死亡;家属完全理解并选择按脑死亡标准停止治疗、捐献器官;同时获得案例所在医院和相关领导部门的同意和支持。(2).中国二类(C-II):国际标准化心死亡器官捐献(DCD),即包括Maastricht标准分类中的M-I~V类案例;其中M-I、M-II、M-IV、M-V 几乎没有争议,但成功几率较小,其器官产出对医疗技术、组织结构及运作效率的依赖性极强。M-III所面临的主要问题是关于“抢救与放弃”之间的医学及伦理学争论,需要用具有法律效力的、权威性的医学标准、共识或指南来保证其规范化实施。(3).中国三类(C-III):中国过渡时期脑-心双死亡标准器官捐献(donation after brain death plus cardiac death, DBCD),即:虽已完全符合DBD标准,但鉴于对脑死亡法律支持框架缺位,现依严格程序按DCD实施;这样做实际上是将C-I类案例按C-II类处理,既类似M-IV类,又不同于M-IV类(M-IV为非计划性、非预见性脑死亡后心脏停搏)。
3. DCD供体器官捐献流程 虽然伦理学方面的担忧已经存在,但是,已建立公认的操作程序,以保证以遵循伦理学的方式从无心跳供体切取器官。DCD供体器官捐献过程如下:①决定停止治疗。②决定在死亡后进行器官捐献。③生命支持治疗的撤除,此后观察90 min。④如果循环停止,宣布死亡并进行器官捐献;如果超过90 min循环未停止,继续支持治疗,终止器官捐献。⑤循环终止,等待5 min。⑥切取器官。⑦器官切取完成。
4. DCD肺移植临床开展现状 Love等以及Steen等分别于1995年和2001年报道了第1 例受控的和非受控的DCD肺移植。此后世界各地陆续有DCD供肺应用于临床的报道,其中以澳大利亚墨尔本以及西班牙马德里尤为活跃,前者以受控的无心跳供体为主,而后者则更倾向于非受控的无心跳供体的利用;国内陈静瑜等也开展了6例DCD供体肺移植。Mason 等总结了全美20 年来完成的36 例无心跳供体肺移植, 在排除了更多的双肺移植、较低的器官配给评分等利于DCD 肺移植的偏倚后,其存活率仍然优于同期完成的脑死亡供体肺移植。进一步支持通过无心跳供体的利用来缓解供体严重短缺的问题。
5.DCD供肺的并发症与预后 主要并发症包括:原发性移植物失功(primary graft dysfunction,PGD)、气道并发症、闭塞性细支气管炎。DCD供肺的近期并发症发生率升高,有准备型DCD术后近期并发症发生率较低,无准备型DCD近期并发症发生率明显上升,单就目前数据显示,DCD肺移植并不增加术后BOS的发生率。对于无准备型DCD,Gomez-de-Antonio等报道3个月、1年、2年及5年存活率分别为78%、68%、57%及51%,与ISHLT平均数据相近。而对于有准备型DCD,若干肺移植中心的结果显示预后满意,术后长期存活。
二、活体肺叶移植
供体短缺已成为阻碍肺移植发展的主要障碍,儿童供体短缺尤为显著。为缓解这一矛盾,活体肺叶移植(living-donor lobar lung transplantations,LDLLT) 于1990年由Starnes首先应用于临床,随后Starnes博士主要在南加利福尼亚大学及洛杉基儿童医院开展活体肺叶移植,华盛顿大学报道了38例LDLLT,日本岗山大学的Date等也报道了30余例LDLLT,2011年姜格宁教授开展了国内首例活体肺叶移植。其长期生存率类似于或优于ISHLT报道的尸体肺叶移植。但有可能给供体带来并发症,让健康人承受肺叶切除术的风险是否值得,仍然存在争论。
三、 ABO血型不相容供体
采用ABO血型不相容的器官是缓解移植供者短缺的潜在途径。随着血浆置换、免疫吸附等技术的发展,国内外相继开展了ABO血型不相容的实体器官移植,包括肾移植、肝移植、心脏移植和肺移植等。ABO血型不相容的实体器官移植能够有效缓解供、受者血型比例失调的矛盾,为更多等待器官移植的患者提供机会。ABO血型不相容的肾移植、肝移植以及婴儿心脏移植,与ABO血型相容的移植相比,近期效果较差,但远期效果基本相同。目前全世界仅报道7例ABO血型不相容的肺移植和1例ABO血型不相容的心肺移植,均为个案报道。心肺移植的1例在术后早期死亡,其余7例均存活6个月以上。国内尚无相关报道。
四、在边缘供体中应用常温体外供肺灌注
边缘供体增加了供体来源,然而术后易出现PGD,早期死亡率较高,其应用应较为慎重。常温体外供肺灌注(Ex vivo lung perfusion, EVLP)可以作为供肺评估和术前预处理的平台。按预计心排量的40%,采用无细胞高浓度溶液顺行灌注供肺,灌注液经供肺氧和后,通过中空纤维氧合器处理,移除氧气,并维持生理浓度的二氧化碳;灌注液再通过温度交换器,保持常温,通过白细胞滤器,移除损坏的白细胞(见图1-2)。通过测量灌注供肺前后的氧分压差异,评估供肺的功能。EVLP的应用,有助于降低原发性移植物功能障碍,并提高供肺利用率,其他优点包括:EVLP技术能够有效改善肺水肿、脑死亡相关炎症、肺部感染、误吸、肺栓塞、缺血再灌注损伤,并提供免疫学准备。供体的质量直接影响着移植患者的预后及长期效果,边缘供体的使用虽然增加了肺移植供体的来源,多数移植中心也制定了相应的使用标准以保证移植术后能实现正常的呼吸功能,但边缘供体毕竟不同于正常供体,其近期并发症发生率较高。因此,术前需要对其质量进行评估,其目的是尽可能保证受体健康生存,保证移植物能在移植术后较长时间内维持正常功能。
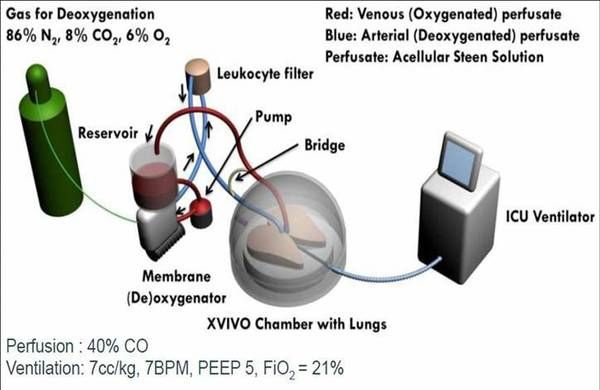
图1常温体外供肺灌注操作示意图
图2 常温体外供肺灌注实际操作图
五、总结
当前供体严重匮乏仍是肺移植开展的主要障碍,使用边缘供体不能从根本上解决供体短缺的问题,其他处于试验阶段的方法值得我们去期待,包括异种移植、人工肺以及器官克隆等。目前,如何最大程度地使用边缘供体,DCD供体,合理地分配稀缺的器官,仍需进一步研究。
